
- Autor Stanley Ellington ellington@answers-business.com.
- Public 2023-12-16 00:14.
- Naposledy změněno 2025-01-22 15:56.
V následujících situacích převod a IND jsou noví i bývalí vlastníci povinni předložit informace FDA. To zahrnuje dopis od bývalého vlastníka, který uvádí, že všechna práva k aplikaci byla udělena přestoupil na nového vlastníka a že nový vlastník obdrží nebo obdržel kompletní IND záznam.
Jak potom podám IND?
Podání IND vyžaduje vyplnění 3 sad formulářů: 1 s podrobnostmi o studii (formulář 1571 FDA), 1 poskytující informace o zkoušejícím a místě studie (formulář FDA 1572) a 1 potvrzující, že studie je registrována v národní databázi klinických hodnocení (FDA Formulář 3674).
Navíc, co je NDA a IND? The NDA aplikace je prostředek, jehož prostřednictvím sponzoři léků formálně navrhují, aby FDA schválila nové léčivo k prodeji a marketingu v USA. IND ) stát se součástí NDA.
Když vezmeme v úvahu toto, co je schválení IND?
Investigational New Drug amerického úřadu pro kontrolu potravin a léčiv ( IND ) program je prostředek, kterým farmaceutická společnost získává povolení k zahájení klinických studií na lidech a k odeslání experimentálního léku přes státní hranice (obvykle klinickým výzkumníkům) před tím, než dojde k marketingové žádosti léku
Je vyžadováno ind?
Obecně platí, že výzkumný nový lék ( IND ) aplikace je Požadované když je hlavním záměrem jakékoli klinické výzkumné studie vyvinout informace, které navrhují použití nebo hodnocení bezpečnosti a/nebo účinnosti neschváleného léku.
Doporučuje:
Jak převedu kubické stopy na čtvereční stopy?

Krychlové stopy = čtvereční stopy × hloubka. Takže: 20 × 0,25 = 5. Máme celkem: 5 krychlových stop
Jak převedu svůj rotační telefon na digitální?

Jak mohu používat rotační telefon na digitální lince? Kupte si převodník pulzního vytáčení na dotykový tón. Připojte kabel převaděče k rotačnímu telefonu. Jeden konec telefonního kabelu zapojte do výstupu převaděče a druhý konec telefonního kabelu zapojte do telefonní zásuvky nebo digitálního zařízení. V příručce naleznete pokyny týkající se konkrétních jednotek
Jak převedu Docker na Kubernetes?
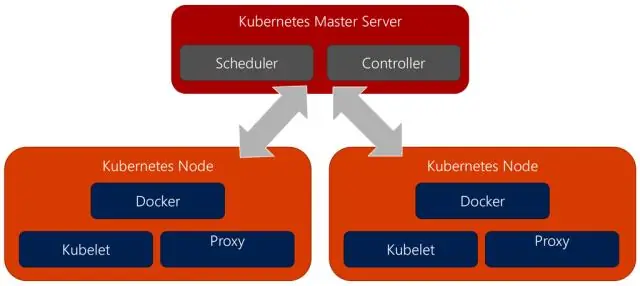
Použití Kompose Přejděte do adresáře obsahujícího váš docker-compose. yml soubor. Spusťte příkaz kompose up pro přímé nasazení do Kubernetes nebo místo toho přeskočte na další krok a vygenerujte soubor, který chcete použít s kubectl. Chcete-li převést docker-compose
Jak převedu svou realitní licenci na jiného makléře na Floridě?

Při převodu od jednoho PRO brokera k jinému postupujte podle následujících kroků: Váš nový broker musí převést vaši licenci do své kanceláře v rámci DBPR na MyFloridaLicense.com. Ověřte, že vaše licence byla převedena, vyhledáním vaší licence na MyFloridaLicense.com. Vyplňte formulář PRO převod
Jak převedu svůj voucher podle oddílu 8?

Ano, po splnění specifických podmínek mohou být poukázky na výběr bydlení podle § 8 převedeny do servisní oblasti jiného úřadu veřejného bydlení (PHA). Tento proces se označuje jako přenositelnost. Pro účely přenositelnosti odkazuje HUD na PHA, která jako první vydala poukaz pro domácnost, jako na „počáteční PHA“
